活動・成果
共同・受託研究等
知的財産
組織
医療・健康・福祉
医学部
ウィルス学分野

医歯学系 准教授・医歯学系 助教・医歯学系 客員研究員
髙橋 雅彦・垣花 太一・藤井 雅寛 TAKAHASHI Masahiko・KAKIHANA Taichi・FUJII Masahiro
| 専門分野 | ウイルス学、神経変性疾患 |
|---|---|
| キーワード | ウイルス、神経変性疾患、神経毒性、蛋白質凝集体、細胞死 |
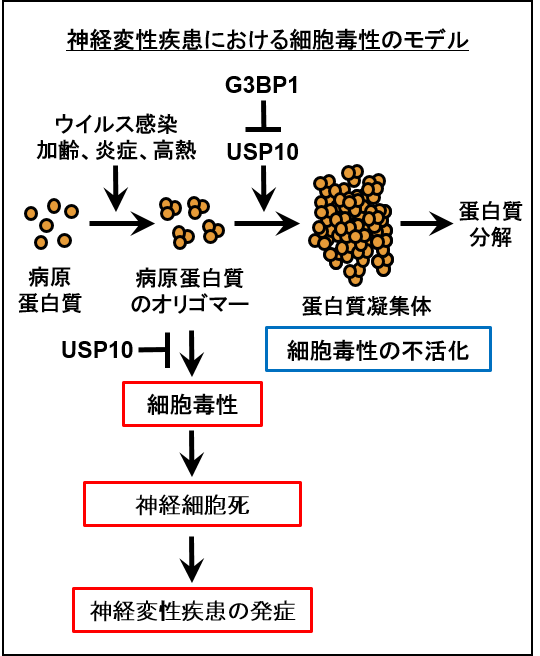
私たちは、ウイルス(HTLV-1、ヘルペスウイルスなど)による神経変性疾患(HTLV-1関連脊髄症、ヘルペス脳炎など)および、非ウイルス性の神経変性疾患(パーキンソン病、アルツハイマー病および筋萎縮性側索硬化症など)の病態を解明することを目指しています。後者の疾患では、それぞれの病気の原因となる蛋白質(αシヌクレイン、タウ、TDP-43)がオリゴマーを形成し、神経細胞に蓄積し、このオリゴマーが神経毒性を示します。私たちは、ウイルスの神経病態に関与する宿主蛋白質(USP10、G3BP1、OptineurinおよびTIA1)を同定し、これらが非ウイルス性の神経変性疾患の病態にも関与していることを明らかにしました。USP10、G3BP1、OptineurinおよびTIA1は、神経変性疾患において、神経毒性と蛋白質凝集体の形成を制御していました(論文1-4)。これらの蛋白質を標的とした神経変性疾患の治療薬の開発を目指しています。
| 関連する知的財産論文等 | 1. Takahashi et al., USP10 Inhibits Aberrant Cytoplasmic Aggregation of TDP-43 by Promoting Stress Granule Clearance, Mol. Cell. Biol., 2022. 2. Sango et al., USP10 inhibits the dopamine-induced reactive oxygen species-dependent apoptosis of neuronal cells by stimulating the antioxidant Nrf2 activity, J. Biol. Chem,, 2021. 3. Kakihana et al., The optineurin/TIA1 pathway inhibits aberrant stress granule formation and reduces ubiquitinated TDP-43. iScience, 2021. 4. Anisimov et al., G3BP1 inhibits ubiquitinated protein aggregations induced by p62 and USP10. Sci. Rep., 2019. |
|---|
認知症や運動障害などの神経変性疾患の病態には、さまざまなウイルス感染が関与しています。これらの病態を解明するために、病態モデルマウスなどを用いて、ウイルス感染症と神経変性疾患を同時に解析しています。
・神経変性疾患、感染症、がん、加齢性疾患などに関心がある企業、製薬会社および自治体など。
